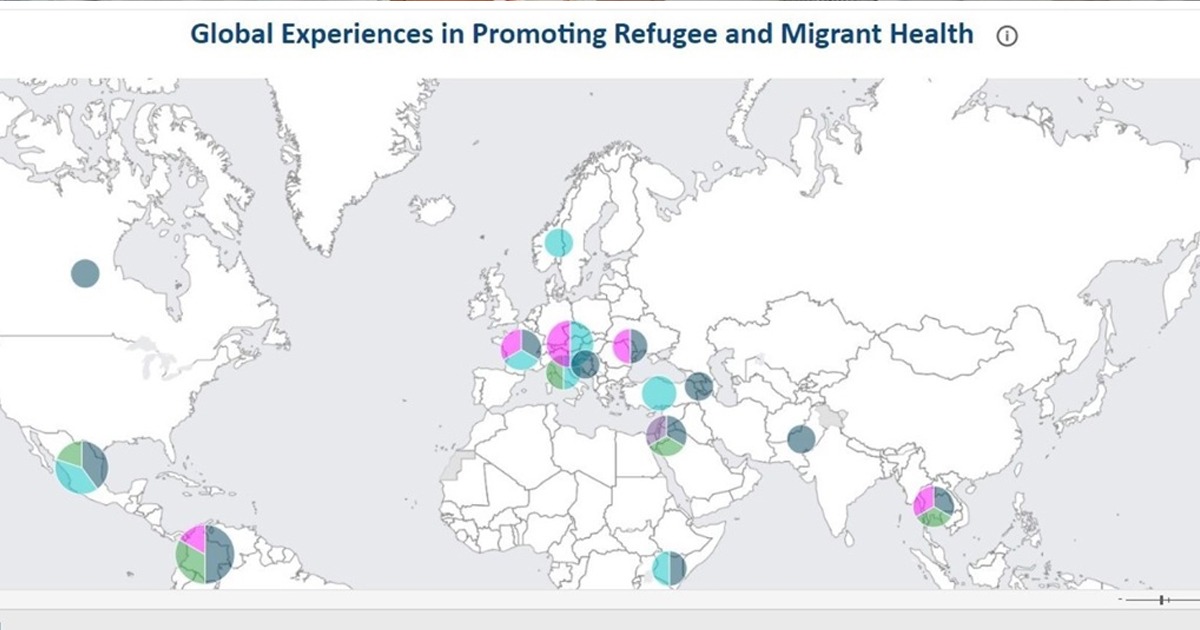
Los principios rectores para planes de control de cambios predeterminados en dispositivos médicos habilitados para aprendizaje automático.
En octubre de 2023, la Administración de Alimentos y Medicamentos de Estados Unidos (FDA, en inglés), Health Canada y la Agencia Reguladora de Productos Sanitarios y Medicamentos del Reino Unido (MHRA, en inglés) publicaron un conjunto de principios que ofrecen orientación sobre el desarrollo de Buenas Prácticas de Aprendizaje Automático (GMLP, en inglés). Estos principios respaldan la creación de tecnologías de inteligencia artificial (IA)/aprendizaje automático seguras, efectivas y de alta calidad que pueden aprender del uso en el mundo real y, en algunos casos, mejorar el rendimiento del dispositivo.
En este documento, estas entidades conjuntamente identificaron cinco principios guía para los planes de control de cambios predeterminados. Estos principios se basan en los diez principios rectores de GMLP publicados en 2021, especialmente en el principio 10 que establece que los modelos desplegados se monitorean y se gestionan los riesgos de reentrenamiento.
El avance de las tecnologías de salud digital incluye dispositivos médicos habilitados para IA/aprendizaje automático (DMIA, en inglés). Las expectativas regulatorias que se alinean con las mejores prácticas para el desarrollo y la gestión de cambios, como se describen en los Principios Rectores de GMLP, pueden contribuir a mantener la calidad de estos dispositivos. Esto puede llevar a beneficios para los pacientes, como un acceso más temprano a tecnologías innovadoras o diagnósticos más precisos.

El proceso de gestión de cambios ayuda a garantizar la seguridad y eficacia continuas de los dispositivos ante cambios a lo largo del ciclo de vida total del producto. Sin embargo, ciertos cambios en los DMIA, como modificaciones en un modelo o algoritmo, pueden ser sustanciales o significativos, lo que puede requerir supervisión regulatoria adicional, como una revisión previa al mercado. Estas expectativas regulatorias no siempre coinciden con el ritmo rápido del desarrollo de DMIA.
A nivel internacional, la comunidad de dispositivos médicos está debatiendo el uso de planes de control de cambios predeterminados (PCCP, en inglés) como una forma de gestionar ciertos cambios en dispositivos que normalmente requieren autorización regulatoria antes de su comercialización.
De esta manera, los PCCP pueden ser utilizados para:
- Alinear los procesos regulatorios con el enfoque rápido y continuo de la gestión de cambios en los DMIA.
- Gestionar riesgos de manera oportuna y continua mediante el monitoreo, el mantenimiento y/o la mejora del rendimiento del dispositivo.
- Mantener altos estándares regulatorios para garantizar la seguridad y eficacia del dispositivo.
Estos principios brindan consideraciones fundamentales que resaltan las características de PCCP sólidos y fomentan la colaboración continua entre las partes interesadas en torno al concepto de PCCP para DMIA. Al igual que con los Principios Rectores de GMLP, este documento busca sentar las bases para los PCCP y promover la armonización internacional.
La cooperación y colaboración internacional, así como el consenso de las partes interesadas en torno a los conceptos básicos de PCCP contribuirán al avance de innovaciones responsables en el ámbito de la Salud Digital.