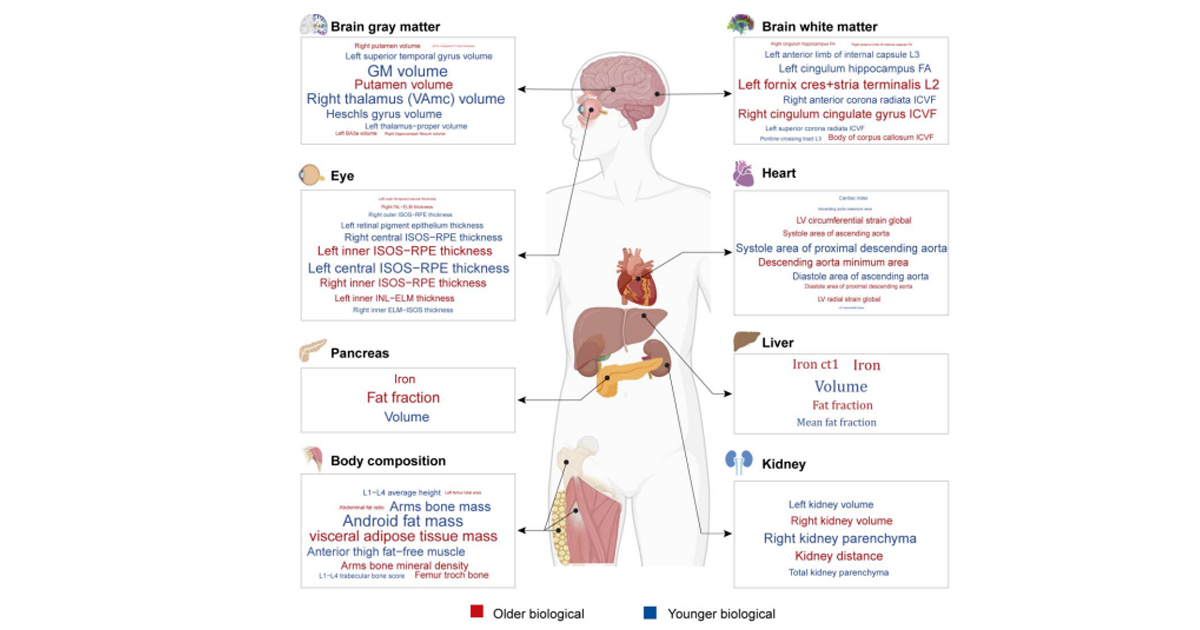
La Administración de Alimentos y Medicamentos de EE.UU. (FDA), Health Canada y la Agencia Reguladora de Medicamentos y Productos Sanitarios (MHRA) del Reino Unido, identificaron los principios para las buenas prácticas de aprendizaje automático.
The FDA, Health Canada, y la MHRA, identificaron de manera conjunta los diez principios rectores para el desarrollo de buenas prácticas de machine learning (GMLP, en inglés). La idea principal es promover el uso de dispositivos médicos seguros, regulados y de calidad que utilicen Artificial Intelligence (AI) and machine learning.
“Con la inteligencia artificial y el machine learning progresando tan rápidamente, nuestras tres agencias reguladoras, juntas, ven una oportunidad global para ayudar a fomentar las buenas prácticas de machine learning al proporcionar principios rectores que creemos respaldarán el desarrollo y la maduración de las buenas prácticas de aprendizaje automático”, explicó Bakul Patel director del Centro de Excelencia de Digital Health of the FDA.

También explicó que los principios rectores que trabajaron con las autoridades sanitarias de Canadá y Reino Unido brindarán un apoyo determinante a los desarrolladores de dispositivos basados en machine learning que “tienen el potencial de mejorar significativamente la calidad de la atención al paciente y transformar la atención médica”, según resaltó Patel.
La “Guía de Buenas prácticas de machine learning para el desarrollo de dispositivos médicos: principios rectores”, fue publicada el 27 de octubre de 2021. De manera resumida los diez principios son los siguientes:
- Multidisciplinary expertise is leveraged throughout the product lifecycle
- Se implementan buenas prácticas de ingeniería de software y seguridad
- Los participantes del estudio clínico y los conjuntos de datos son representativos de la población de pacientes prevista
- Los conjuntos de datos de entrenamiento son independientes de los conjuntos de prueba
- Los conjuntos de datos de referencia seleccionados se basan en los mejores métodos disponibles
- El diseño del modelo se adapta a los datos disponibles y refleja el uso previsto del producto
- La atención se centra en el rendimiento del equipo humano de la AI
- Las pruebas demuestran el rendimiento del dispositivo en condiciones clínicamente relevantes
- Los usuarios reciben información clara y esencial: Los usuarios tienen fácil acceso a información clara y contextualmente relevante que es apropiada para la audiencia a la que va dirigida (como los proveedores de atención médica o los pacientes)
- Deployed models are monitored for performance and retraining risks are managed
Puedes consultar la guía completa en el siguiente enlace: https://www.gov.uk/government/publications/good-machine-learning-practice-for-medical-device-development-guiding-principles/good-machine-learning-practice-for-medical-device-development-guiding-principles
AI MEAS
FDA
UK GOV