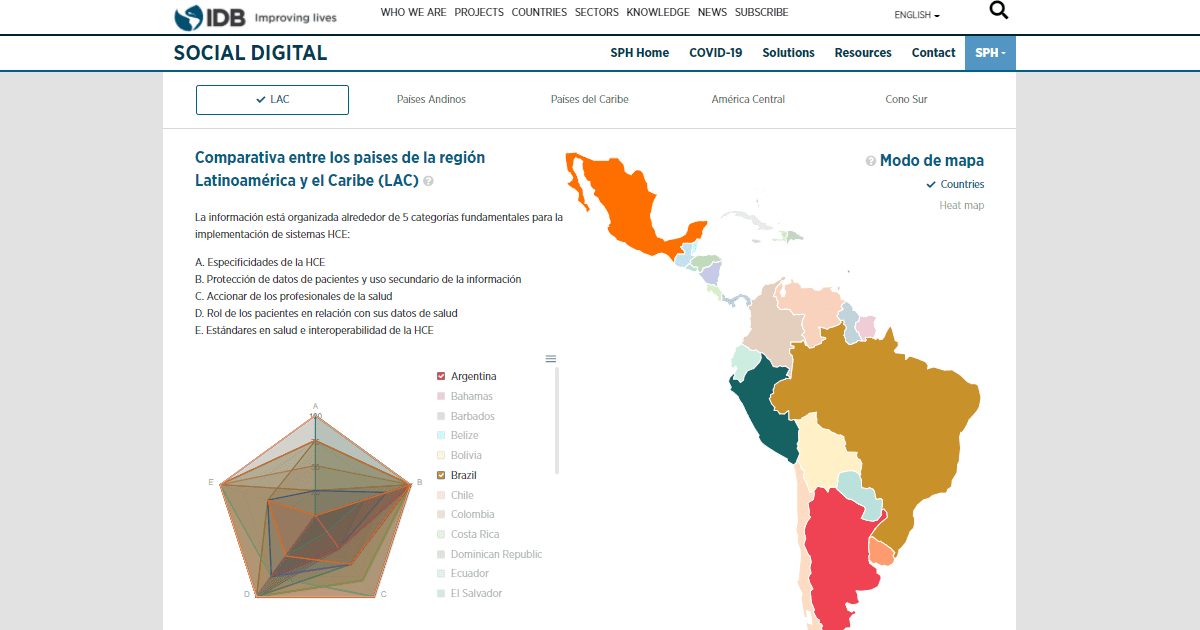
Los nuevos software y aplicaciones móviles catalogados como soluciones de Salud Digital, deben contar con regulaciones para evitar desinformación y promover uso de tecnologías con sustento científico.
El uso de aplicaciones móviles de salud ha incrementado en los últimos años, sin embargo, existen desafíos de estas herramientas de Salud Digital. El acceso a este tipo de soluciones debe darse en un contexto donde su uso se encuentre regulado.
En Estados Unidos la Administración de Alimentos y Medicamentos (FDA, por sus siglas en inglés), ha regulado los últimos años ciertos dispositivos médicos, sin embargo, aplicaciones de monitoreo y registro de síntomas no se encuentran reguladas al ser consideradas de bajo riesgo.
La FDA se encarga de regular y aprobar dispositivos médicos cuando son productos finales, como software, algoritmos, Inteligencia Artificial entre otros. A este tipo de tecnologías se les ha nombrado Software como dispositivos médicos (SaMD, en inglés).
Los SaMD son definidos por el Foro Internacional de Reguladores de Dispositivos Médicos (IMDRF, por sus siglas en inglés) lo define como “software destinado a ser utilizado para uno o más propósitos médicos que realizan estos propósitos sin ser parte de un dispositivo médico de hardware”.

La FDA clasifica los SaMD en tres categorías, el software que es un dispositivo médico por sí solo, el software que es parte integral de un dispositivo médico y el software que se utiliza para la fabricación o mantenimiento de un dispositivo médico.
El IMDRF, ha desarrollado guías para respaldar el uso de este tipo de tecnologías, promoviendo que sean seguros y eficaces.
Avances de la COFEPRIS
En México la Comisión Federal para la Protección contra Riesgos Sanitarios (COFEPRIS) ha creado un Grupo de Trabajo en Regulación Innovadora para SaMD. Esto es importante ya que las compañías que buscan implementar SaMD en el mercado mexicano se rigen por normas extranjeras y están fuera de las regulaciones mexicanas.
Este tipo de acciones buscan garantizar altos estándares para proteger la integridad de los usuarios con productos probados antes de ser introducidos en el país. De esta forma COFEPRIS busca que las regulaciones sean un ejercicio más democrático.
Los objetivos de la COFEPRIS en cuanto a la regulación de SaMD es la evaluación de la NOM 241 SSA1 2020 y la detección de modificaciones necesarias que pueden ser abordadas por la COFEPRIS.
El grupo de Trabajo esta conformado por compañías médicas y farmacéuticas, así como instituciones académicas como el Consejo Nacional de Ciencia y Tecnología (Conacyt), el Colegio de Ingenieros Biomédicos.
El objetivo para 2021 es concluir las tareas del grupo de trabajo: la clasificación de los dispositivos médicos basados en software; definir los SaMD y sus regulaciones; diseñar las regulaciones; y diseñar las normativas.
Y el objetivo para 2022 es cambiar las Normas Oficiales Mexicanas que involucren términos, operaciones, vigilancia y supervisión relacionada con SaMD.