Un modelo de IA permite segmentar con alta precisión los principales haces de la sustancia blanca del tronco cerebral y detectar anomalías asociadas a enfermedades neurodegenerativas.
Un equipo de investigadores del MIT, Harvard y Mass General Hospital, desarrolló una herramienta basada en inteligencia artificial (IA) capaz de segmentar de forma automática ocho haces de sustancia blanca en el tronco cerebral humano, una región pequeña pero crucial para funciones como la respiración, el ritmo cardiaco y la conciencia. El estudio fue publicado en Proceedings of the National Academy of Sciences y propone una nueva base para mapear con precisión la conectividad del tronco cerebral en personas sanas y en pacientes con enfermedades neurológicas.
El tronco cerebral concentra fibras nerviosas recubiertas de mielina que actúan como autopistas de comunicación entre distintas regiones del cerebro. Sin embargo, su tamaño reducido, su compleja organización y el ruido asociado a la adquisición de imágenes por resonancia magnética dificultan su estudio detallado. Hasta ahora, la segmentación de estos haces requería etiquetado manual por expertos, un proceso lento y poco escalable.
“El tronco encefálico es una región del cerebro que, en esencia, no se explora porque es difícil visualizarla”, afirma el Dr. Mark Olchanyi, doctorando del Programa de Ingeniería Médica y Física Médica del MIT. “Se desconoce su composición desde la perspectiva de la imagen. Necesitamos comprender cómo está organizada la sustancia blanca en los humanos y cómo se descompone en ciertos trastornos”.
De esta manera, los investigadores crearon el BrainStem Bundle Tool, o BSBT, un modelo de red neuronal convolucional diseñado específicamente para identificar estructuras pequeñas y agrupadas. El sistema combina imágenes de resonancia magnética por difusión con un mapa probabilístico de fibras generado mediante tractografía automatizada. Además, incorpora mecanismos de atención y un refinamiento estadístico final que mejoran la detección de límites anatómicos sutiles.
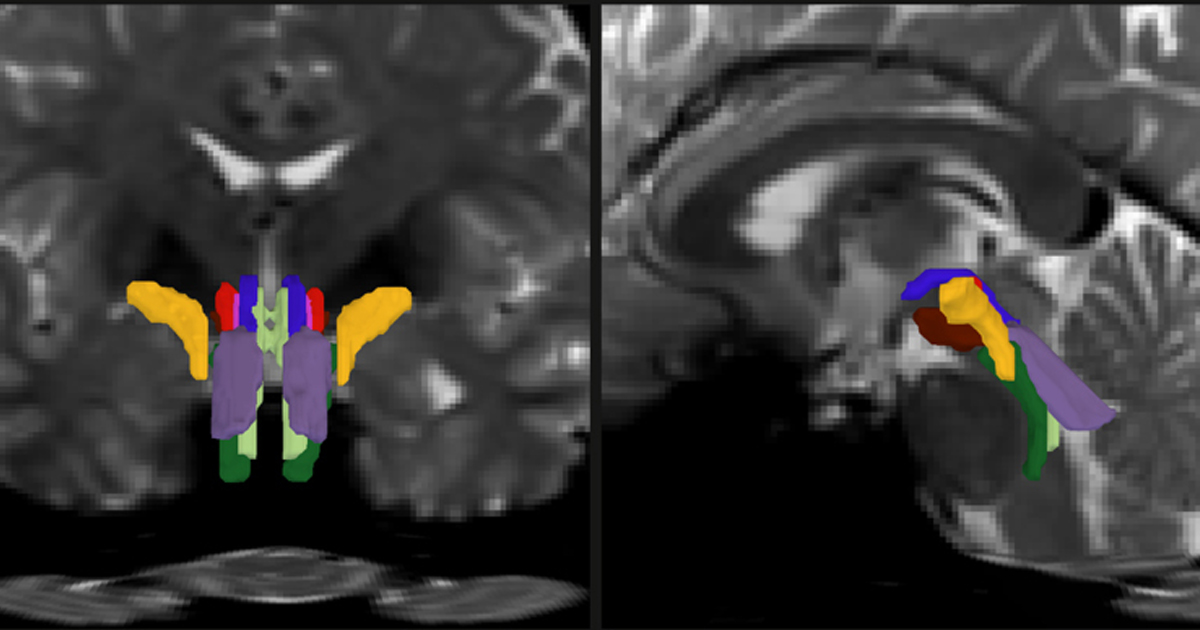
“Al mejorar nuestra capacidad para obtener imágenes del tronco encefálico, nos ofrece un nuevo acceso a funciones fisiológicas vitales como el control de los sistemas respiratorio y cardiovascular, la regulación de la temperatura, cómo nos mantenemos despiertos durante el día y cómo dormimos por la noche”, expresó el Dr. Emery N. Brown supervisor de tesis de Olchanyi.
El modelo fue validado en cerebros humanos estudiados tanto in vivo como ex vivo. En total, se compararon las segmentaciones automáticas con anotaciones manuales en 25 sujetos sanos escaneados con alta resolución, 10 controles adicionales con otro protocolo clínico y 7 cerebros ex vivo.
En los sujetos del Human Connectome Project, el sistema alcanzó un coeficiente Dice promedio de 0.70 y una distancia de Hausdorff de 2.11 milímetros, métricas que reflejan un alto grado de coincidencia espacial con las anotaciones de referencia. En los otros conjuntos de datos, el desempeño se mantuvo estable, con Dice de 0.66 y 0.62 según el protocolo. Además, en un análisis test–retest con 40 personas evaluadas en dos ocasiones separadas por casi cinco meses, la mayoría de los haces mostró una confiabilidad elevada, con coeficientes de correlación intraclase superiores a 0.8.
Una vez validado, el sistema se aplicó a distintas cohortes clínicas. En 106 personas con enfermedad de Alzheimer o deterioro cognitivo leve y 122 controles, casi todos los haces del tronco cerebral mostraron reducción de volumen, con disminuciones significativas en el haz mesencefálico homeostático.
En 72 pacientes con enfermedad de Parkinson y 52 controles, el análisis reveló reducciones significativas de anisotropía fraccional en estructuras como el haz lateral del prosencéfalo y el pedúnculo cerebeloso superior. En tareas de clasificación para distinguir pacientes y controles a dos años de seguimiento, el modelo basado en los haces del tronco cerebral alcanzó áreas bajo la curva de hasta 0.69 para anisotropía y 0.63 para volumen, resultados comparables o superiores a otros enfoques automatizados.
En 98 personas con esclerosis múltiple y 50 controles, varios haces mostraron reducciones significativas tanto en integridad microestructural como en volumen. El clasificador basado en anisotropía fraccional de los haces del tronco cerebral alcanzó un área bajo la curva de 0.80, superando incluso a máscaras globales de sustancia gris hemisférica.
El equipo también aplicó la herramienta a 17 pacientes con traumatismo craneoencefálico grave. En este grupo, la clasificación basada en anisotropía fraccional alcanzó un área bajo la curva de 0.77, superior a otros enfoques globales.
De manera destacada, se presentó el caso de un hombre de 29 años en coma por una hemorragia mesencefálica extensa. En la fase aguda, el volumen de la lesión fue de 1,962 milímetros cúbicos y se redujo a 679 milímetros cúbicos a los siete meses. El mapa probabilístico permitió demostrar que varios haces estaban desplazados pero no completamente interrumpidos, lo que pudo explicar su recuperación funcional parcial. Sin esta información probabilística, la segmentación sugería una desconexión más severa.
Los autores concluyen que esta herramienta establece una base para el mapeo automatizado y escalable de la conectividad del tronco cerebral. Al permitir evaluar de manera reproducible la integridad y la morfología de haces específicos, el método podría facilitar la identificación de biomarcadores de imagen en múltiples trastornos neurológicos y mejorar la comprensión del papel del tronco cerebral en la homeostasis y la conciencia.
Los autores concluyen que en este campo, donde la mayor parte de los modelos de IA se han centrado en grandes estructuras cerebrales, es posible abordar con precisión regiones pequeñas y complejas.







