Gracias al Programa de Precertificación que se encarga de regular los alimentos y medicamentos mediante un software dentro del gobierno estadounidense, diversas empresas obtuvieron el registro de dispositivos médicos, algoritmos basados en inteligencia artificial y herramientas de diagnóstico.
La Agencia de Administración de Medicamentos y Alimentos (FDA por sus siglas en inglés, Food and Drug Administration) ha estado abocando esfuerzos en la adopción de innovaciones. El Dr. Norman Sharpless, nuevo comisionado de la agencia, ha impulsado la decisión sobre hacer un llamado a nuevas empresas para que prueben el marco actual de su Programa de Precertificación de Software de Salud Digital.
El objetivo del programa es facilitar la regulación de los productos de Salud Digital propensos a actualizaciones frecuentes. De esta manera, las nuevas compañías y startups pueden asegurarse de que sus esfuerzos están 100% certificados por el gobierno de Estados Unidos y así estar exentos a multas y avisos regulatorios.
El Centro de Dispositivos y Salud Radiológica de la FDA (encargado de darle continuidad al programa) tiene una sola prioridad: los pacientes. Brindar acceso a innovaciones de alta calidad, segura y efectiva, desde aplicaciones móviles, sensores para le medición de actividad física, entre otros, es primordial. Del mismo modo, el uso de algoritmos embebidos en plataformas digitales que favorezcan la toma de decisiones clínicas que los médicos toman a diario, es de vital importancia.
El esfuerzo consciente del gobierno de Estados Unidos por mejorar la experiencia del usuario a través de la Salud Digital no se detiene en la certificación de nuevas empresas. También han puesto el foco en alertar a pacientes y proveedores de servicios de salud, al advertirles sobre los peligros de los dispositivos y software para el control de la diabetes y otras enfermedades crónicas que no han sido evaluados por la agencia.
“Debemos asegurarnos de que podemos continuar brindando un estándar de primera en términos de seguridad y efectividad. Creemos que la orientación de la agencia ayudará a avanzar en el desarrollo de estos productos innovadores”, declaró el Dr. Scott Gottlieb, antiguo comisionado de la FDA.
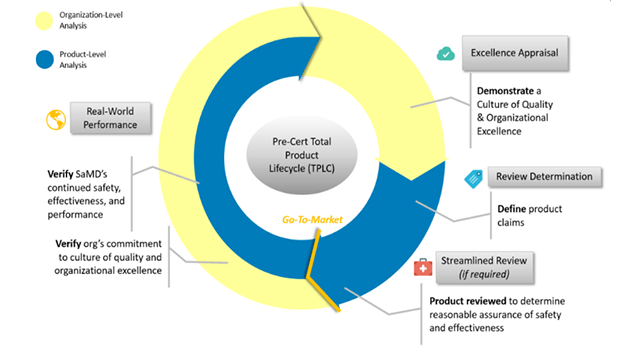
El planteamiento del ciclo de vida total del producto de la FDA permite evaluar y monitorear un producto de software desde su desarrollo previo a la comercialización hasta el desempeño posterior a su venta. Esto trae un beneficio específico, el cual es una supervisión reguladora personalizada y pragmática que evalúe a las organizaciones de todos los tamaños, para establecer la confianza de que tienen una cultura de calidad y excelencia que resulte en productos seguros para el paciente.
Es muy importante conocer, dar a conocer y verificar que todos los dispositivos y tecnologías que se adopten para el cuidado de la salud cumplan con normas de calidad y protección en favor de los usuarios.